Plan de cours
consigne : à faire en classe
- Cours (lire et comprendre) : livre §4 p.142 – §1 p.156 – §2 p.156
- Activité (à faire) : livre 1 p.152 OU 4 p.141
- Exercices (à faire) : 17 p.146 – 7 p.158 – 21 p.147 – 23 p.162
Devoirs à la maison
- Cours et vocabulaire à apprendre (recopier ou résumer)
- Visualiser les activités complémentaires PCCL les vidéos, les documents
- Applications vérification et utilisation des connaissances
Exercices 10,15,17,19,21,23,25,27 p.144 et 1,7,8,11,14,15,16,23,26 p.158
Cours et vocabulaire
§4 p.142
Le pH varie entre 0 et 14, et se mesure avec un pH-mètre ou du papier pH. Le pH vaut 7 lorsqu’il y a autant d’ions hydrogène H+ que d’ions hydroxyde HO–. La solution est alors neutre d’un point de vue acido-basique.
Plus le pH est inférieur à 7, plus la solution est acide et contient d’ions hydrogène H+.
Plus le pH est supérieur à 7, plus la solution est basique et contient d’ions hydroxyde HO–.
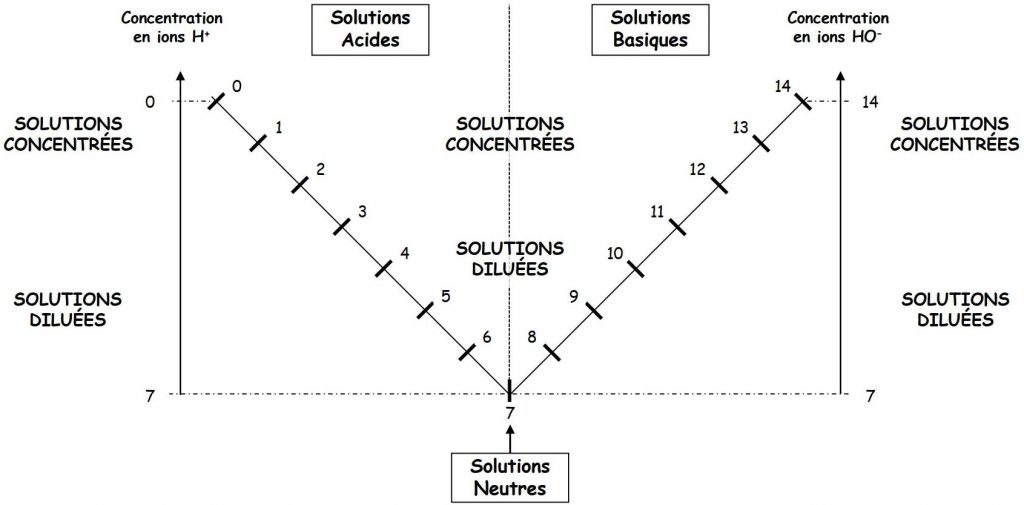
pH est compris entre 0 et 7 : solution acide.
pH est compris entre 7 et 14 : solution basique.
pH est égal à 7 : solution neutre.
§1 p.156
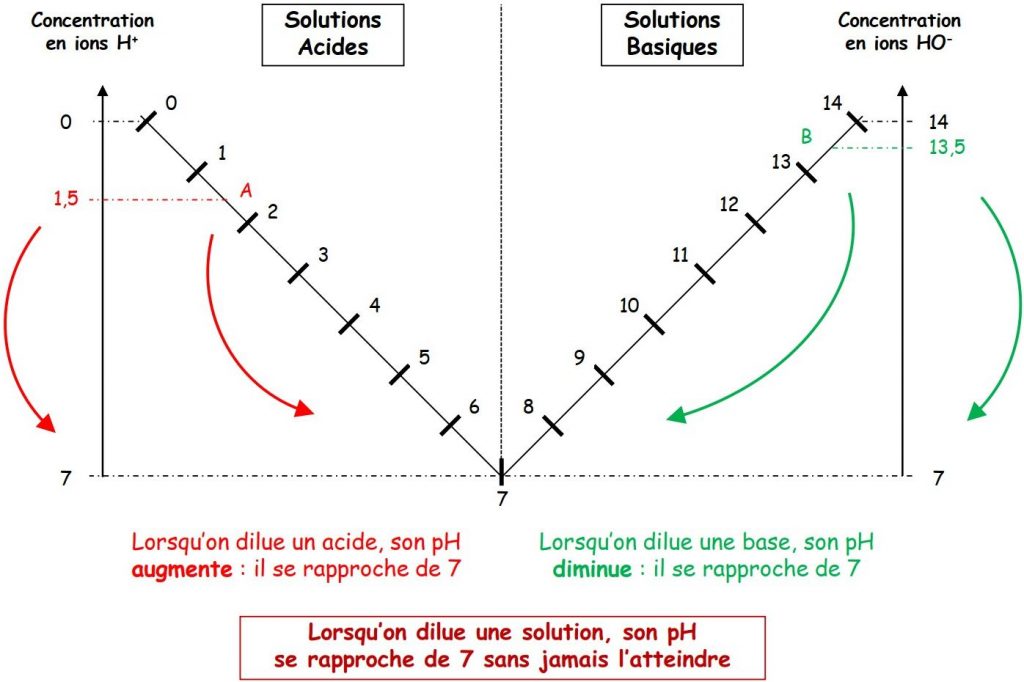
La dilution est une transformation physique. Elle consiste à augmenter la quantité de solvant présent dans une solution. Au cours d’une dilution, le pH d’une solution évolue et se rapproche de 7.
§2 p.156
Mélanger des solutions d’acide chlorhydrique (H+ + Cl−) et de soude (Na+ + HO−) donne une solution dont le pH est plus proche de 7 que des solutions de départ. Les ions hydrogène H+ de l’une et hydroxyde HO− de l’autre sont consommés : la réaction a pour équation-bilan H+ + HO− → H2O. La réaction entre une solution acide et une solution basique est une réaction acidobasique.
| Vocabulaire | Définition |
| pH | valeur liée à la quantité d’ions H+ |
| acide | pH entre 0 et 7, présence majoritaire d’ions hydrogène H+ |
| solution basique | pH entre 14 et 7, présence majoritaire d’ions hydroxyde HO– |
| dilution | modification d’une solution par l’ajout de solvant, le pH se rapproche de 7 |
| papier-pH | papier spécial qui est imbibé d’un indicateur |
| concentrer | augmenter la quantité d’une substance par rapport au volume de la solution |
Livre
Activités
Travaux pratiques – test d’acidité au chou rouge
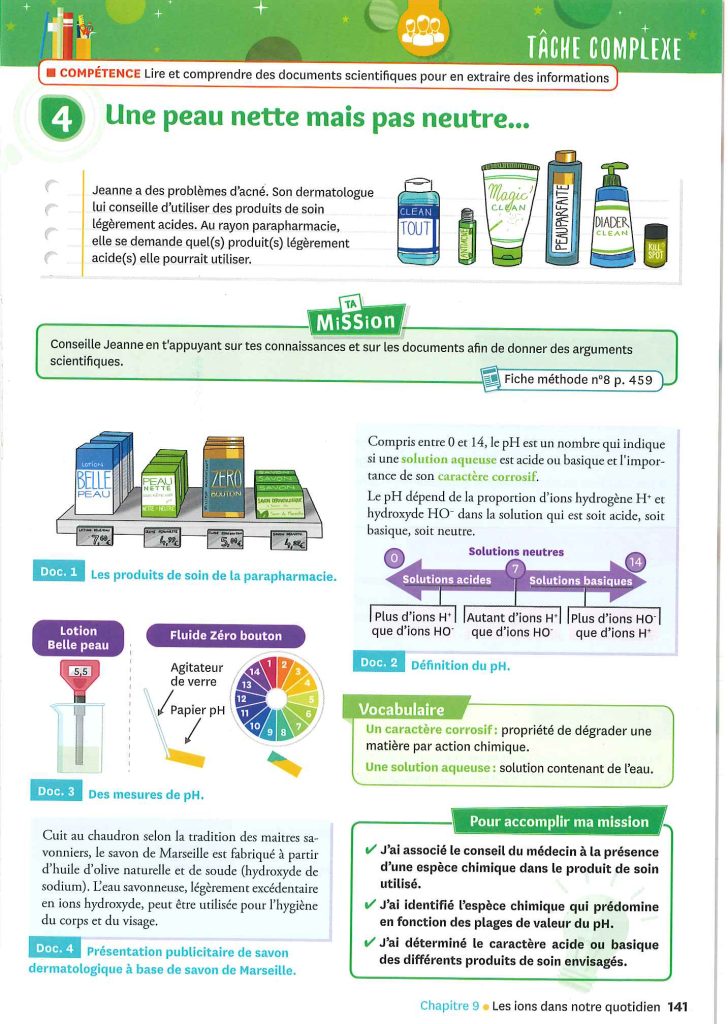
activité 4 p.141 : Une peau nette mais pas neutre…
Livre
Corrigé
Jeanne a des problèmes d’acné. Son dermatologue lui conseille d’utiliser des produits de soin légèrement acides. Au rayon parapharmacie, elle se demande quel(s) produit(s) légèrement acide(s) elle pourrait utiliser.
Le pH de la Lotion Belle peau est 5,5
Le pH du Fluide Zéro bouton est de 8
Le pH du savon de Marseille est supérieur à 7, car il est indiqué que l’eau savonneuse est légèrement excédentaire en ions hydroxyde.
L’étiquette du savon Peau Nette indique (en tout petit) pH 7
Selon les conseils de son dermatologue, le savon légèrement acide qu’elle pourrait utiliser serait la Lotion Belle peau. Le pH 5,5 indique une légère présence d’ions H+

activité 1 p,152 : Acides et bases : nettoyer… sans danger ?
Livre

Corrigé
1) En mesurant le pH des solutions avant et après dilution, on pourra se rendre compte que la solution de vinaigre devient moins acide après une dilution et que la solution d’eau de Javel devient moins basique après une dilution.
2) Protocole de mesure :
- Découper un morceau de papier pH et le poser dans une coupelle blanche propre et sèche.
- Rincer une baguette en verre à l’eau distillée puis l’essuyer avec le papier essuie-tout.
- Prélever une goutte de vinaigre d’alcool avec la baguette en verre en plongeant une de ses extrémités dans le bécher (ou flacon) qui contient la solution.
- Déposer la goutte de solution prélevée sur le papier pH.
- Lire le pH correspondant à la teinte prise par le papier pH.
- Reprendre les étapes 1 à 5 avec les autres solutions de vinaigre d’alcool puis avec les solutions d’eau de Javel.
3) Voici les valeurs du pH que l’on peut trouver :
Pour le vinaigre :
| Vinaigre pure | Dilué 10 fois | Dilué 100 fois |
| Environ pH 3 | Environ pH 4 | Environ pH 5 |
Si le vinaigre est très acide, il est possible que la première solution diluée ait le même pH que le vinaigre.
Pour l’eau de javel :
| Eau de javel | Dilué 10 fois | Dilué 100 fois |
| Environ pH 12 | pH 11 | pH 10 |
4) Plus le pH d’une solution est éloigné de 7, plus cette solution est corrosive et dangereuse.
5) On constate que plus on dilue une solution, plus le pH se rapproche de 7 , pH neutre. Le pH permet donc de vérifier que la dilution réduit la dangerosité des solutions acides et basiques.
6) Si on dilue à l’infini, le pH doit se rapprocher de 7 (le pH du solvant utilisé).
Lumni : cours en vidéo sur la notion de pH https://www.lumni.fr/video/chimie-la-notion-de-ph
activités PCCL
document complémentaire
Applications : vérification des connaissances
exercices 10,15,17,19 p.144 >
exercices 1,7,8,11,14,15,16 p.158 >
utilisation des connaissances
exercices 21,23,25,27 p.144 et 23,26 p.163 >
problème p.148 : Quels sont les ions présents dans l’acide sulfurique ?
Corrigé
Le pH vaut 1, ce qui signifie que ce liquide est très acide et contient des ions hydrogène : H+.
De plus, il se forme un précipité blanc après l’ajout de solution de chlorure de baryum. L’eau de ce lac contient donc des ions sulfates : SO42−
Les ions présents dans l’acide sulfurique sont donc H+ + SO42−
La formule d’une solution d’acide sulfurique est ( 2 H+ + SO42− )
CDT
3e Matière 9 : Notion de pH
https://cours.saettler.org/3m9/
Cours : livre §4 p.142 §1 p.156 §2 p.156
Activité : livre 1 p.152 OU 4 p.141
Exercices : livre 17 p.146 – 7 p.158 – 21 p.147 – 23 p.162
Programme : M2.8 Identifier le caractère acide ou basique d’une solution par mesure de pH » Réactions entre solutions acides et basiques. » Réactions entre solutions acides et métaux. M2.9 Associer le caractère acide ou basique à la présence d’ion H+ et HO− » Ions H+ et HO− » Mesure du pH.
Devoirs
https://cours.saettler.org/3m9/
Retravailler le cours, les activités, les exercices
Apprendre le cours et le vocabulaire (recopier ou résumer)
Visualiser les activités complémentaires PCCL et les fiches méthodes
Faire les exercices : Applications vérification et utilisation des connaissance 10,15,17,19,21,23,25,27 p.144 et 1,7,8,11,14,15,16,23,26 p.158


