Plan de cours
consigne : à faire en classe
- Cours (lire et comprendre) : livre p.44, p.58 et p.72
- Exercice corrigé et similaire (à faire) : livre 10 et 11 p.61
- Exercice corrigé et similaire (à faire) : livre 9 et 10 p.75
- Exercices (à faire) 12 p.62 et 15 p.76
Devoirs à la maison
- Cours et vocabulaire à apprendre (recopier ou résumer)
- Visualiser les activités complémentaires PCCL
- Applications vérification et utilisation des connaissances
Exercices 3,4,5,8,12,15 p.60 et 1,2,3,4,11,13,15,16 p.74
Cours et vocabulaire
Changements d’état
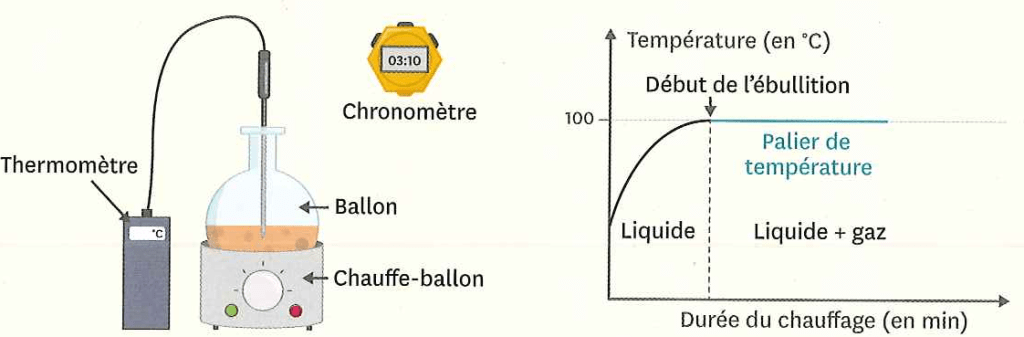
Ébullition des liquides purs
La température d’un corps pur liquide que l’on chauffe augmente jusqu’à une valeur appelée « palier de température » à laquelle elle se stabilise. C’est le moment du changement d’état de l’état liquide à l’état vapeur : des bulles de vapeur se forment au sein du liquide. Cette vaporisation s’appelle une ébullition.
La température d’ébullition de l’eau est de 100 °C.
Le passage de l’état vapeur à l’état liquide est la liquéfaction.
Solidification des liquides purs
La température d’un corps pur liquide que l’on refroidit diminue jusqu’à une valeur à laquelle elle se stabilise. C’est le moment du changement d’état de l’état liquide à l’état solide. C’est une solidification.
Lors de la solidification de l’eau, son volume augmente (ce n’est pas le cas pour toutes les substances) tandis que sa masse reste constante, la quantité d’eau n’ayant pas changé.
La température de solidification de l’eau est de 0 °C.
Le passage de l’état solide à l’état liquide est la fusion.
Ébullition des mélanges liquides
Il n’existe pas de « palier de température » lors des changements d’état des mélanges (eau salée).
Mélanges
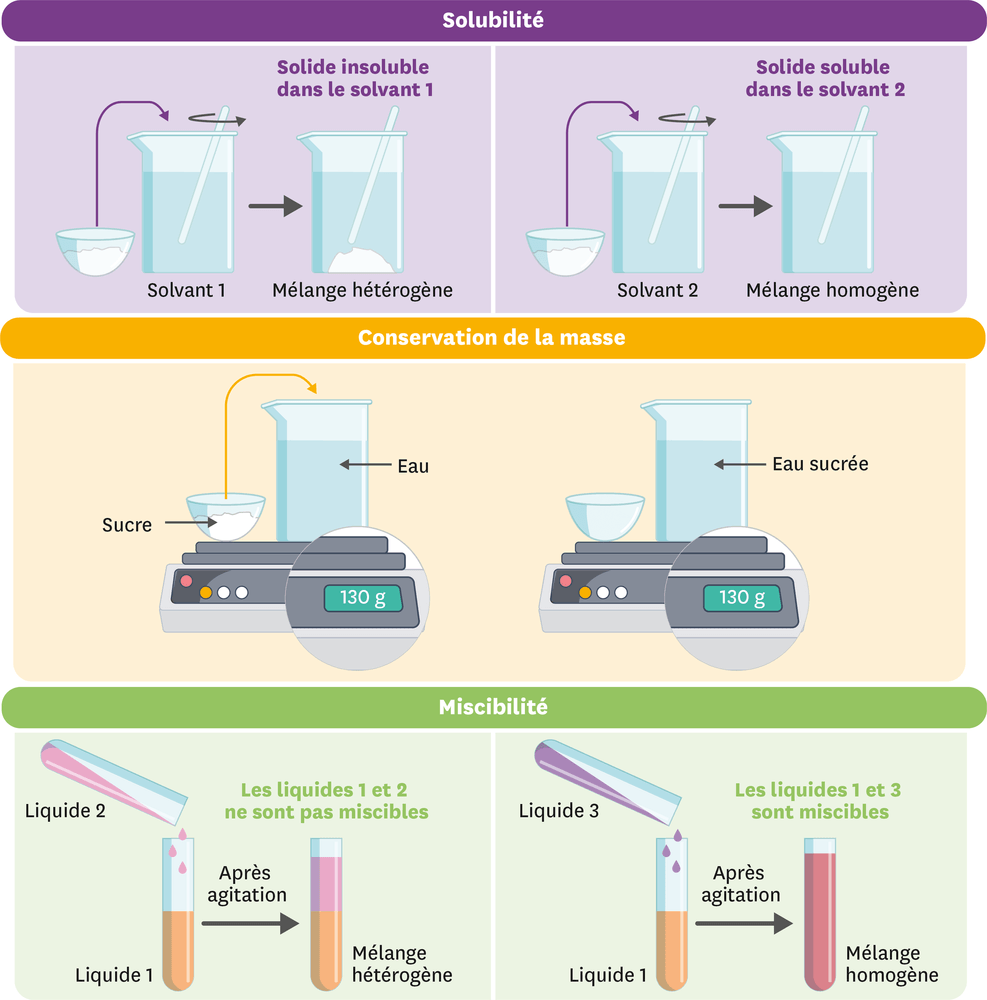
Étude de la solubilité d’un solide dans un liquide
Lors d’une dissolution, la substance dissoute s’appelle le soluté. Le liquide dans lequel ce solide est dissout s’appelle le solvant. Le mélange homogène obtenu est appelé solution. Le solide ajouté est soluble dans ce liquide (il se mélange).
Si le mélange obtenu après ajout est hétérogène, on dit que le solide ajouté est insoluble dans ce liquide.
Y a-t-il une limite à la solubilité ?
La masse maximale de soluté que l’on peut dissoudre est appelée solubilité. La solution est alors saturée.
Lors d’une dissolution, il y a conservation de la masse : la masse d’une solution est égale à la somme des masses du soluté et du solvant.
Mélange de deux liquides
Lorsque le mélange de deux liquides donne un mélange homogène, les liquides concernés sont dits miscibles (ex. : l’eau et le sirop).
En cas d’obtention d’un mélange hétérogène, les liquides concernés sont dits non miscibles (ex. : l’eau et l’huile).
| Vocabulaire | Définition |
| solidification | passage de l’état liquide à l’état solide |
| fusion | passage de l’état solide à l’état liquide (la glace fond) |
| liquéfaction | passage de l’état gazeux à l’état liquide |
| vaporisation | passage de l’état liquide à l’état gazeux |
| mélange homogène | mélange dont les constituants ne se distinguent pas à l’œil nu |
| mélange hétérogène | mélange dont les constituants se distinguent à l’œil nu |
| soluté | substance dissoute dans un solvant (sel) |
| solvant | liquide capable de dissoudre des substances liquides ou gazeuses (eau) |
| solution | mélange homogène (eau salée) contenant un solvant (eau) et un soluté (sel) |
| solution saturée | solution dans laquelle on ne peut plus dissoudre de soluté, qui a atteint son niveau de solubilité |
| solubilité | masse maximale de soluté que peut contenir un litre de solution. |
| soluble | se dit d’un soluté (sel) qui peut être dissout dans un solvant (eau) |
| insoluble | se dit d’un soluté (sable) qui ne peut pas être dissout dans un solvant (eau) |
| miscible | se dit d’un liquide (sirop) qui peut être dissout dans un solvant (eau) |
Livre
chapitre 2 – chapitre 3 – chapitre 4
Activités pour comprendre
Changement d’état
Exercices corrigés 10 p.61 et similaire 11 p.61
Livre

activités PCCL
- Solidification – eau pure / Solidification – eau salée / Solidification – cyclohexane
- Fusion – eau pure / Fusion – eau salée
- Vaporisation – eau pure / Vaporisation – eau salée
Mélanges
Exercices corrigés 9 p.75 et similaire 10 p.75
Livre

activités PCCL
- 06 Dissolution et masse
- 07 Dissolution – Dilution – Fusion : Quelles différences ?
- 08 Miscibilité
Applications de vérification des connaissances
exercices 3,4,5,8,12,15 p.60>
exercices 1,2,3,4,11,13,15,16 p.74>
CDT
3e Matière 1 : Prérequis – rappels de 5e
https://cours.saettler.org/3m1
Cours : livre p.44, p.58 et p.72
Exercice corrigé et similaire : livre 10 et 11 p.61
Exercice corrigé et similaire : livre 9 et 10 p.75
Exercices : livre 12 p.62 et 15 p.76
Programme : M1.5 Proposer et mettre en œuvre un protocole expérimental pour déterminer une masse volumique d’un liquide et d’un solide
M1.6 Exploiter des mesures de masse volumique pour différencier des espèces chimiques
» Masse volumique : Relation m = ρ.V
Devoirs
https://cours.saettler.org/3m1
Retravailler le cours, les activités, les exercices
Apprendre le cours et le vocabulaire (recopier ou résumer)
Visualiser les activités complémentaires PCCL
Faire les exercices : Applications vérification et utilisation des connaissances 3,4,5,8,12,15 p.60 et 1,2,3,4,11,13,15,16 p.74