Vous prenez la fiche Matière 9. Vous complétez les deux premiers exercices. Ce sont les 3 atomes et certaines des molécules à connaître à partir de la 4e.

corrigé

Exercice : 3. De quels atomes est formée la molécule de dioxyde de carbone CO2 ?
(développer pour voir le corrigé)
CO2 est la formule du dioxyde de carbone.
Analysons cette formule.
La formule CO2 est comme C1O2. La lettre C est le symbole de l’atome de carbone. Le chiffre 1 est rendu invisible (tout comme en maths on écrit x + 2 au lieu de 1x + 2). La lettre O est le symbole de l’atome d’oxygène. Le chiffre 2 représente le nombre d’atomes d’oxygène.
Ainsi, la formule CO2 (ou C1O2) représente une molécule composée d’un atome de carbone et de deux atomes d’oxygène.
Attention à l’écriture : CO2 et non CO2, le 2 est en indice car sinon on ne peut pas savoir si c’est O ou 0 et on se retrouve avec des incompréhensions : 2 O2 ou 202.
Le code de ce langage chimique est très précis, il faut donc l’utiliser avec précision.
Exercices :
4. Quelle est la formule de la molécule de dioxygène ?
5. La molécule de saccharose (sucre) a pour formule C12H22O11, préciser le nom et le nombre des atomes.
6. Le fructose (sucre des fruits) contient 6 atomes de carbone, 12 atomes d’hydrogène et 6 atomes d’oxygène, écrire la formule du fructose.
7. L’aspartame (édulcorant) a pour formule C14H18N2O5, préciser le nom et le nombre des atomes. (N est le symbole de l’atome d’azote).
Correction des exercices
4. Écriture : Pour trouver la formule de la molécule de dioxygène, il faut connaître le nombre d’atomes composant la molécule. di oxygène veut dire 2 atomes d’oxygène, la formule est donc O2
5. Lecture : Pour la molécule de saccharose, sa formule est C12H22O11
elle est donc composée de 12 atomes de carbone ( C12 dans la formule)
de 22 atomes d’hydrogène ( H22 dans la formule)
et 11 atomes d’oxygène ( O11 dans la formule)
6. Écriture : La molécule de fructose contient 6 atomes de carbone : C6 dans la formule
12 atomes d’hydrogène : H12 dans la formule
et 6 atomes d’oxygène : O6 dans la formule
sa formule est donc C6H12O6
7. Il existe 118 atomes, en 4e, vous n’avez à en connaître que 3, mais on peut vous en faire utiliser d’autres.
N est le symbole de l’atome d’azote (N vient de nitrogène, nom de l’azote en anglais)
Lecture : La formule de l’aspartame est C14H18N2O5
elle est composée de 14 atomes de carbone, 18 atomes d’hydrogène, 2 atomes d’azote et 5 atomes d’oxygène.
Logiciel Reachim de Serge Lagier,
Lancer le logiciel ReaChim (dans menu Démarrer >Physique-Chimie).
Menu Fichier > Ouvrir un fichier d’équations à équilibrer puis saisir vos coordonnées.
Ouvrir le fichier Combustion.EQU et répondre.
Le logiciel propose d’équilibrer une équation-bilan, il montre les atomes des réactifs et les atomes des produits.
Il s’agit de mettre les bons coefficients pour avoir l’équilibre pour chaque type d’atomes.
Vous pouvez aussi essayer les fichiers : Debutant.EQU ; CombustAlcane.EQU ou Reactions.EQU
Ce logiciel peut être téléchargé et installé sur votre équipement : https://cours.saettler.org/eq-bilan/
Exercice :
Compter les atomes des réactifs et des produits pour trouver l’équation-bilan de la combustion du carbone :
C + O2 → CO2 + H2O ou C + O2 → CO ou C + O2 → CO2
Correction de l’exercice
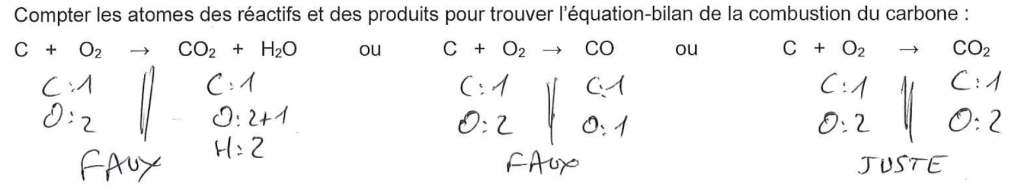
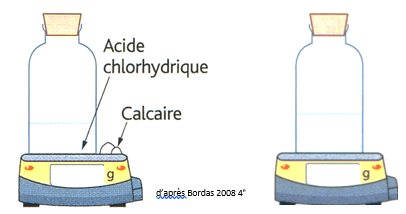
Quelle est la masse des réactifs ?132g
Quelle est la masse des produits ? 132g
Rédiger la conclusion : lors d’une réaction chimique, la masse totale des réactifs est égale à la masse totale des produits : la masse se conserve
Rien ne se perd, rien ne se crée, tout se transforme
Lavoisier, 1789
