Consignes de travail
Avant le cours – préparation :
Compléter la fiche de travail à l’aide de la partie Cours et vocabulaire.
Faire les exercices Application – vérification des connaissances, et compléter la fiche de travail.
Étudier les Activités complémentaires (vidéos, liens, autres fiches,…).
Identifier les questions à poser lors du cours.
Pendant le cours – compréhension :
Poser les questions identifiées lors de la préparation du cours.
Faire les activités restantes proposées.
Après le cours – apprentissage :
Apprendre par cœur le Cours et vocabulaire.
Terminer toutes les activités et exercices d’application.
Livre
chapitre 2 – chapitre 3 – chapitre 4
Cours et vocabulaire

à la maison
Ébullition des liquides purs
La température d’un corps pur liquide que l’on chauffe augmente jusqu’à une valeur appelée « palier de température » à laquelle elle se stabilise. C’est le moment du changement d’état de l’état liquide à l’état vapeur : des bulles de vapeur se forment au sein du liquide. Cette vaporisation s’appelle une ébullition.
La température d’ébullition de l’eau est de 100 °C.
Le passage de l’état vapeur à l’état liquide est la liquéfaction.
Solidification des liquides purs
La température d’un corps pur liquide que l’on refroidit diminue jusqu’à une valeur à laquelle elle se stabilise. C’est le moment du changement d’état de l’état liquide à l’état solide. C’est une solidification.
Lors de la solidification de l’eau, son volume augmente (ce n’est pas le cas pour toutes les substances) tandis que sa masse reste constante, la quantité d’eau n’ayant pas changé.
La température de solidification de l’eau est de 0 °C.
Le passage de l’état solide à l’état liquide est la fusion.
Ébullition des mélanges liquides
Il n’existe pas de « palier de température » lors des changements d’état des mélanges (eau salée).
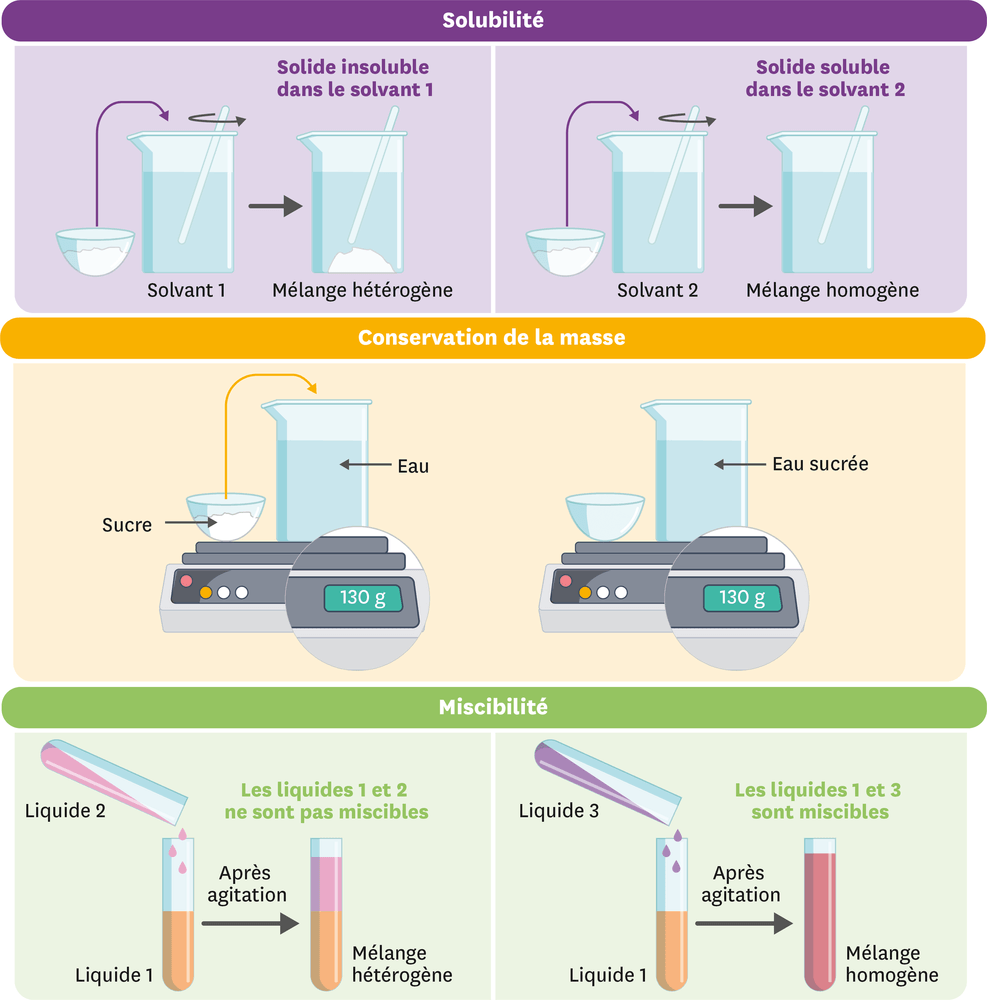
Étude de la solubilité d’un solide dans un liquide
Lors d’une dissolution, la substance dissoute s’appelle le soluté. Le liquide dans lequel ce solide est dissout s’appelle le solvant. Le mélange homogène obtenu est appelé solution. Le solide ajouté est soluble dans ce liquide.
Si le mélange obtenu après ajout est hétérogène, on dit que le solide ajouté est insoluble dans ce liquide.
Y a-t-il une limite à la solubilité ?
La masse maximale de soluté que l’on peut dissoudre est appelée solubilité. La solution est alors saturée.
Lors d’une dissolution, il y a conservation de la masse : la masse d’une solution est égale à la somme des masses du soluté et du solvant.
Mélange de deux liquides
Lorsque le mélange de deux liquides donne un mélange homogène, les liquides concernés sont dits miscibles (ex. : l’eau et le sirop).
En cas d’obtention d’un mélange hétérogène, les liquides concernés sont dits non miscibles (ex. : l’eau et l’huile).
Vocabulaire :
mélange homogène, mélange hétérogène, soluté, solvant, solution, solution saturée, solubilité, soluble, insoluble, miscible
Activités
activités pour comprendre (en classe)
Changement d’état
Exercices corrigés 10 p.61 et similaire 11 p.61
activités PCCL
- Solidification – eau pure / Solidification – eau salée / Solidification – cyclohexane
- Fusion – eau pure / Fusion – eau salée
- Vaporisation – eau pure / Vaporisation – eau salée
Mélanges
Exercices corrigés 9 p.75 et similaire 10 p.75
activités PCCL
- 06 Dissolution et masse
- 07 Dissolution – Dilution – Fusion : Quelles différences ?
- 08 Miscibilité
Applications
vérification des connaissances

à la maison