Consignes de travail
Avant le cours – préparation :
Compléter la fiche de travail à l’aide de la partie Cours et vocabulaire.
Faire les exercices Application – vérification des connaissances, et compléter la fiche de travail.
Étudier les Activités complémentaires (vidéos, liens, autres fiches,…).
Identifier les questions à poser lors du cours.
Pendant le cours – compréhension :
Poser les questions identifiées lors de la préparation du cours.
Faire les activités restantes proposées.
Après le cours – apprentissage :
Apprendre par cœur le Cours et vocabulaire.
Terminer toutes les activités et exercices d’application.
Livre
Cours et vocabulaire

à la maison
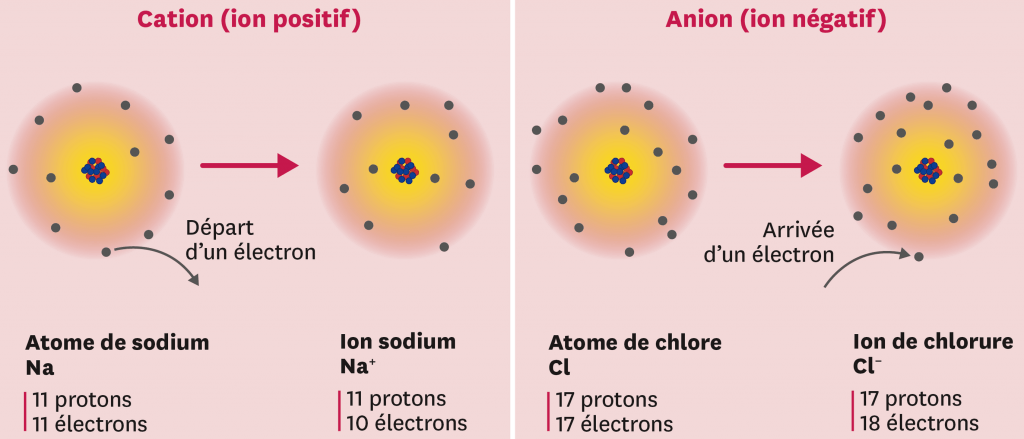
Un ion est un atome ou une molécule qui a gagné ou perdu un ou plusieurs électrons.
L’ajout (le gain) d’un ou plusieurs électrons donne un ion négatif : un anion. Par exemple, l’atome de chlore Cl gagne un électron pour devenir l’ion chlorure Cl−.
La perte d’un ou plusieurs électrons donne un ion positif : un cation. Par exemple, l’atome de cuivre Cu perd deux électrons pour devenir l’ion cuivre Cu2+.
Un solide ionique est un assemblage régulier d’anions et de cations. Par exemple des cristaux de sels sont composés d’autant d’ions Na+ que d’ions Cl−.
Une solution ionique est une solution de cations et d’anions, le plus souvent aqueuse. Sa formule s’écrit entre parenthèses avec les formules des ions qu’elle contient. Par exemple, la solution de chlorure de fer s’écrit (Fe3+ + 3 Cl–).
Les solides et les solutions ioniques sont électriquement neutres.
Vocabulaire :
ion, anion, cation, ionique, aqueuse
Activités
activités pour comprendre (en classe)
Activité 3 p.140 Des composés ioniques qui soignent
Qu’est-ce qui détermine la formule chimique d’un composé ionique ?
1) ion sodium : Na+ est un cation ; ion ferrique : Fe3+ est un cation ; ion chlorure : Cl– est un anion.
2.a) On trouve 1 ion sodium pour 1 ion chlorure. D’après sa formule (Na+ + Cl– ), le chlorure de sodium est composé d’un ion sodium par ion chlorure présent.
2.b) Le mélange des 2 ions n’est pas chargé ; il est neutre, autant de charges + que de charges – .
2.c) La charge de l’ion Fe3+ est trois fois plus grande que la charge de l’ion Cl–.
2.d) Afin d’obtenir une solution électriquement neutre, le chlorure ferrique doit contenir trois fois plus d’ions chlorures Cl– que d’ions ferriques Fe3+.
3) La formule chimique du chlorure ferrique est (Fe3+ + 3 Cl– )
activités complémentaire
activités PCCL
Applications
vérification des connaissances

à la maison



